Quando se compara um solvente puro e uma solução de soluto não-volátil, é possível afirmar que o ponto de congelamento da solução sempre será menor que o ponto de congelamento do solvente puro.
Quanto maior o número de partículas dissolvidas em uma solução, menor será o seu ponto de congelamento.
Δtc = Tc2 - Tc, onde:
Tc = temperatura de congelamento da solução
Tc2 = temperatura de congelamento do solvente
Tc2 = temperatura de congelamento do solvente
Osmometria: Estuda o processo da osmose onde a pressão é exercida para evita-lá (pressão osmótica)
Primeira Lei da Osmometria: Em temperatura constante,a pressão osmótica é diretamente proporcional à molaridade da solução.
Em particular, para um número fixo (n1) de mols do soluto, a pressão osmótica será inversamente proporcional ao volume da solução.
• Segunda Lei da Osmometria: Em molaridade constante, a pressão osmótica é diretamente proporcional à temperatura absoluta da solução.
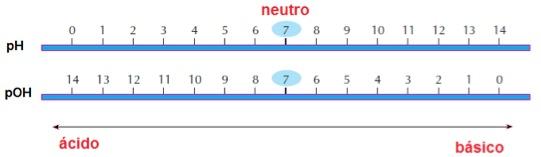
pH: Mede a acidez das substâncias
pOH: Mede a basicidade das substâncias
Kw = [H+][OH-]
Kw = 10-7 . 10-7 = 10-14 (a 25 °C)
Aluna: Thaís do Prado Hashimoto Nº 36
Série: 2B
Fonte: http://www.coladaweb.com/quimica/fisico-quimica/ph-e-poh-equilibrio-ionico-da-agua
http://www.infoescola.com/quimica/ph-e-poh-de-solucoes-aquosas/
http://educacao.globo.com/quimica/assunto/solucoes/propriedades-coligativas.html
http://www.brasilescola.com/quimica/crioscopia.htm
Nenhum comentário:
Postar um comentário